

资讯动态
neotrident news
资讯动态
7月1日,nmpa正式发布《药品记录与数据管理要求(试行)》(以下简称《要求》),并于12月1日起施行。该法规的出台,意味着在国内药品研制、生产、经营和使用活动的全部环节中,电子记录得到了法律法规的肯定,药品数据管理的“电子记录时代”已经来临!
nmpa为何肯定电子记录与纸质记录具有同等法律效力?
创腾医药行业顾问团队认为,电子记录能得到nmpa认可,主要有如下几个方面的原因:
(1)随着信息化程度的不断深入,一些计算机(化)系统所产生的数据与记录形式也越来越复杂,相比简单系统产生的静态数据(如图谱结果、天平称量结果等)而言,由复杂系统产生的大量动态数据(指能反映动态过程的记录)将很难单纯用纸质记录展现其真实情况;
(2)“质量源于设计”,监管部门不断加强对过程的管控要求,药企如果单纯沿用纸质 人工的管理方式,是很难做到合规要求的,而持续合规更是难上加难;
(3)随着云计算,移动互联等信息技术的飞速发展,电子记录的优势日益凸显:精细化过程执行与监控、高效检索、便于查看、安全可靠、易于追溯、利于协作等等,电子记录的推行,将有效提高制药企业以及nmpa监管人员的执行、审核效率,进而促进我国医药行业良性有序的发展。
可见,电子记录终将取代纸质记录已是大势所趋,此《要求》的出台,更是为所有医药领域相关从业人员吃了一颗定心丸!
《要求》既强调“结果”又关注“过程”,与国际法规接轨
第二章 基本要求(部分摘录)
第四条 记录可以根据用途,分为台账、日志、标识、流程、报告等不同类型。从事药品研制、生产、经营、使用活动,应当根据活动的需求,采用一种或多种记录类型,保证全过程信息真实、准确、完整和可追溯。记录载体可采用纸质、电子或混合等一种或多种形式。
第五条 采用计算机(化)系统生成记录或数据的,应当采取相应的管理措施与技术手段,确保生成的信息真实、准确、完整和可追溯。
第六条 电子记录至少应当实现原有纸质记录的同等功能,满足活动管理要求。对于电子记录和纸质记录并存的情况,应当在相应的操作规程和管理制度中明确规定作为基准的形式。
第八条 数据的采集、处理、存储、生成、检索、报告等活动,应当满足相应数据类型的记录填写或数据录入的要求,保证数据真实、准确、完整和可追溯。
从对药品记录与数据管理的“基本要求”中可以看出,为保障药品质量和患者安全,必须在药品的全生命周期范围内,保证其信息、数据的真实、准确、完整和可追溯,这与国际现行主流法规对数据完整性的定义相一致。
实际上,由于实际执行过程的差异,药品研发环节与药品检测/生产环节(gxp环境下),对电子记录系统的功能特点要求其实有很多不同。在确保合规的前提下,创腾科技分别研发了两款eln,有针对性地分别满足研发实验室和检测实验室对电子实验记录的需求。

适用于药品研发环节(gxp环境下)eln
——灵活性与合规性的统一

适用于药品检测/生产环节(gxp环境下)eln
——sop合规执行,严格遵循法规要求
*温馨提示:欲了解产品更多详细内容,请在百度搜索“”、“”。
nmpa《要求》下的电子实验记录j9九游会真人游戏第一品牌赢的解决方案
第四章 电子记录管理要求
第二十条 采用电子记录的计算机(化)系统应当满足以下设施与配置:
(一)安装在适当的位置,以防止外来因素干扰;
(二)支持系统正常运行的服务器或主机;
(三)稳定、安全的网络环境和可靠的信息安全平台;
(四)实现相关部门之间、岗位之间信息传输和数据共享的局域网络环境;
(五)符合相关法律要求与管理需求的应用软件与相关数据库;
(六)能够实现记录操作的终端设备及附属装置;
(七)配套系统的操作手册、图纸等技术资料。
第二十一条 采用电子记录的计算机(化)系统至少应当满足以下功能要求:
(一)保证记录时间与系统时间的真实性、准确性和一致性;
(二)能够显示电子记录的所有数据,生成的数据可以阅读并能够打印;
(三)系统生成的数据应当定期备份,备份与恢复流程必须经过验证,数据的备份与删除应有相应记录;
(四)系统变更、升级或退役,应当采取措施保证原系统数据在规定的保存期限内能够进行查阅与追溯。
第二十二条 电子记录应当实现操作权限与用户登录管理,至少包括:
(一)建立操作与系统管理的不同权限,业务流程负责人的用户权限应当与承担的职责相匹配,不得赋予其系统(包括操作系统、应用程序、数据库等)管理员的权限;
(二)具备用户权限设置与分配功能,能够对权限修改进行跟踪与查询;
(三)确保登录用户的唯一性与可追溯性,当采用电子签名时,应当符合《中华人民共和国电子签名法》的相关规定;
(四)应当记录对系统操作的相关信息,至少包括操作者、操作时间、操作过程、操作原因;数据的产生、修改、删除、再处理、重新命名、转移;对计算机(化)系统的设置、配置、参数及时间戳的变更或修改。
第二十三条 采用电子记录的计算机(化)系统验证项目应当根据系统的基础架构、系统功能与业务功能,综合系统成熟程度与复杂程度等多重因素,确定验证的范围与程度,确保系统功能符合预定用途。
第五章 数据管理要求(部分摘录)
第二十六条 经计算机(化)系统采集、处理、报告所获得的电子数据,应当采取必要的管理措施与技术手段:
(一)经人工输入由应用软件进行处理获得的电子数据,应当防止软件功能与设置被随意更改,并对输入的数据和系统产生的数据进行审核,原始数据应当按照相关规定保存;
(二)经计算机(化)系统采集与处理后生成的电子数据,其系统应当符合相应的规范要求,并对元数据进行保存与备份,备份及恢复流程必须经过验证。
《要求》中的第四章第二十条对电子记录的计算机(化)系统的设施与配置要求做了明确说明。创腾科技凭借二十年制药领域信息化系统部署的实践经验以及对相关行业法规的深入研究与理解,将会对系统硬件配置、软件要求、网络环境等提供完整的方案与建议,帮助用户扫清上系统前的障碍,并提供相应系统配套技术资料,让用户无后顾之忧。
通过对第四章电子记录管理要求及第五章数据管理要求的分析,不难得出结论,nmpa《要求》下的电子实验记录系统j9九游会真人游戏第一品牌赢的解决方案必须要确保药品记录与数据的真实、准确、完整和可追溯,具备完善的审计追踪以及严格的权限密码管理功能,具备符合法规要求的电子签名,以及满足计算机(化)系统验证的要求等。接下来,创腾医药行业顾问团队将从这几个核心角度出发,分析创腾elnj9九游会真人游戏第一品牌赢的解决方案与nmpa《要求》的符合度。
(1)支持手机移动应用,确保数据获取的完整性
系统支持移动应用,通过借助手机app实时获取第一手数据,例如通过语音(转文字)记录操作步骤,实时拍照上传,添加时间戳,自动获取仪器数据等,清除实验记录无纸化过程中的最后一道障碍。
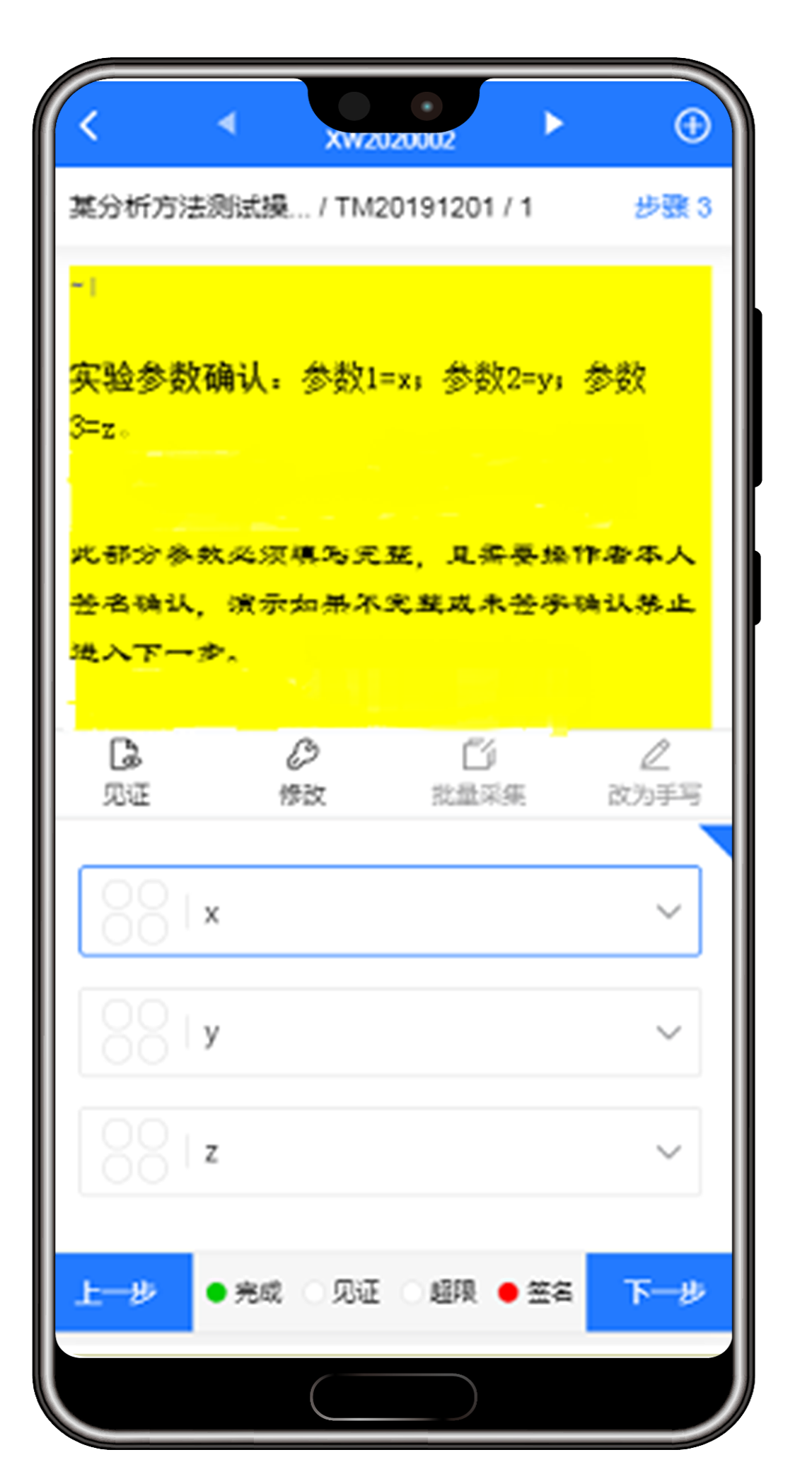
app

app
(2)记录清晰、可查,支持报告导出与打印
具备丰富的检索功能,能够快速定位目标内容。实验记录可直接导出报告并打印。
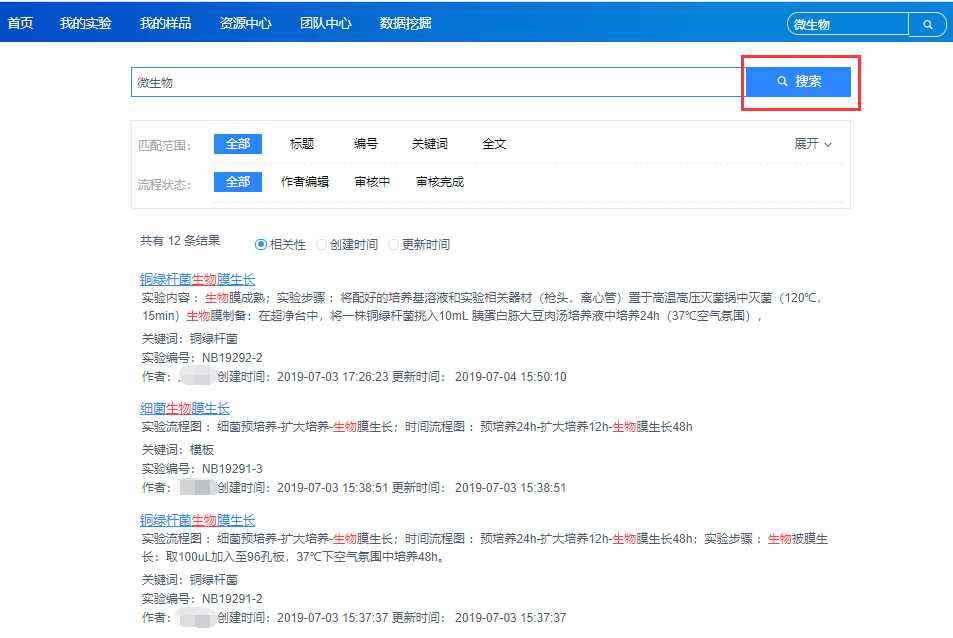
全文检索
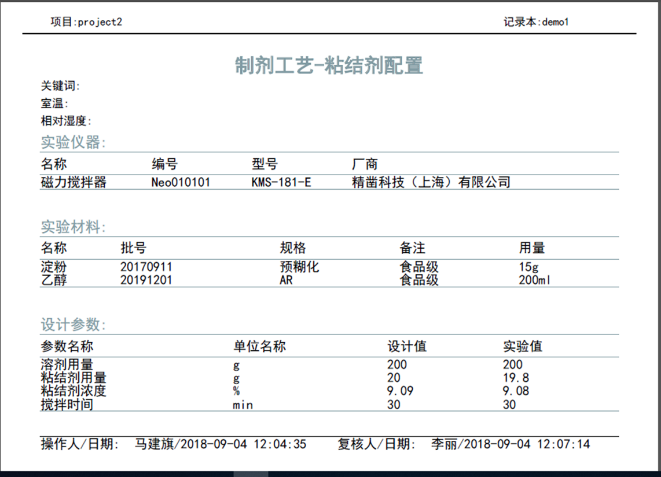
实验报告导出
(3)审计追踪,安全合规
保留系统操作日志,实验记录的每次版本更新与所有修改痕迹均自动保留,生成审计追踪报告并可打印,从而实现“真实、准确、完整和可追溯”。

实验记录审计追踪

系统审计追踪,记录所有系统中的增删改操作
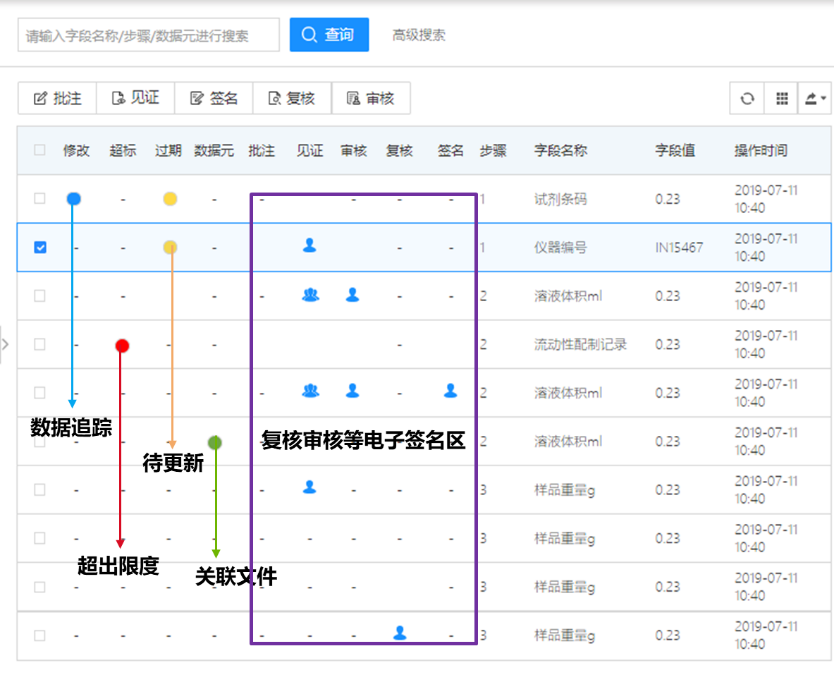
审计追踪
(4)严格的权限密码管理
具备严格的用户权限设置与分配功能,能够对权限的修改进行跟踪与查询,不同角色用户权限可根据其职责范围进行分配,与此同时,通过账号密码管理策略,严格控制数据访问及操作,以确保数据的安全性及有效性。


不同中的用户权限设置界面
(5)电子签名
电子签名,符合fda 21 cfr part 11的相关规定,实现对数据修改、审批等关键操作的控制,确保登录用户的唯一性、可追溯性,以及数据的归属性、不可抵赖性。

(6)数据复核
能够满足数据复核操作的执行,实现人工复核及电子复核,确保数据录入的准确性和处理正确性。
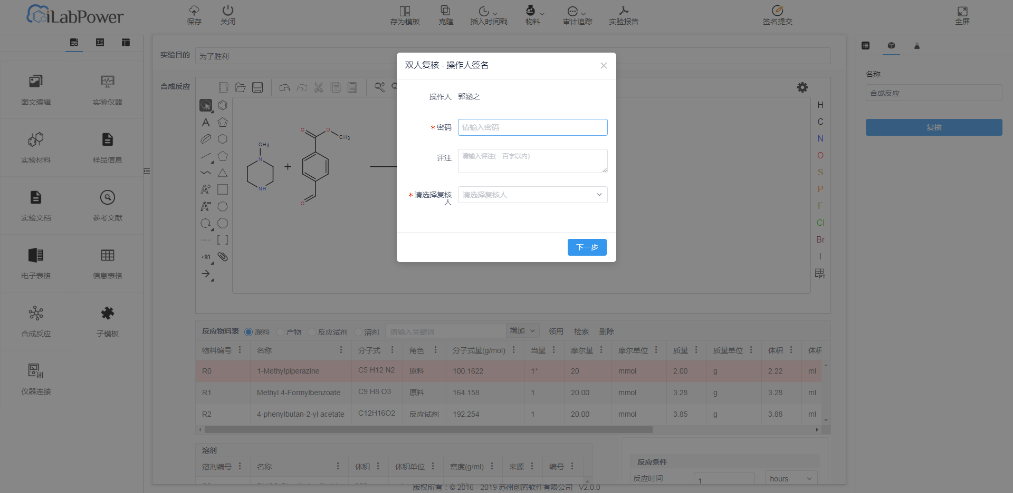

(7)满足计算机(化)系统验证要求
依照ispe gamp5的要求,,隶属4类可配置性系统,具有完善的产品质量验证体系。创腾科技实施团队,严格按照四类验证v模型,已经成功为包括科伦药业在内的国内多家企业提供了计算机(化)系统验证服务,帮助企业顺利通过fda/ema等多个监管部门的核查。

《药品记录与数据管理要求(试行)》原文请访问: